- লেখক Alex Aldridge [email protected].
- Public 2023-12-17 13:33.
- সর্বশেষ পরিবর্তিত 2025-06-01 07:36.
সায়ানোহাইড্রিন এবং নাইট্রিলের মধ্যে মূল পার্থক্য হল সায়ানোহাইড্রিন যৌগগুলিতে একটি সায়ানো গ্রুপ এবং একটি হাইড্রক্সি গ্রুপ থাকে যেখানে নাইট্রিল যৌগগুলিতে শুধুমাত্র সায়ানো গ্রুপ থাকে৷
সায়ানোহাইড্রিন এবং নাইট্রিল যৌগ উভয়েই সায়ানো গ্রুপ (-সিএন ফাংশনাল গ্রুপ) ধারণ করে। এই যৌগগুলিতে এই কার্যকরী গোষ্ঠীগুলি একটি অ্যালকাইল বা আরিল গ্রুপের সাথে সংযুক্ত থাকে; এইভাবে, আমরা তাদের জৈব যৌগ হিসাবে শ্রেণীবদ্ধ করতে পারি।
সায়ানোহাইড্রিন কি?
Cyanohydrin হল একটি জৈব যৌগ যার সাধারণ রাসায়নিক সূত্র R2C(OH)CN রয়েছে। এই যৌগগুলির প্রতি অণুতে দুটি কার্যকরী গ্রুপ রয়েছে: সায়ানো গ্রুপ এবং হাইড্রক্সি গ্রুপ।এই দুটি কার্যকরী গ্রুপ একই কার্বন পরমাণুর সাথে সংযুক্ত। এই কার্বন পরমাণুটি একটি অ্যালকাইল বা অ্যারিল গ্রুপের সাথে আরও সংযুক্ত থাকে, অথবা উভয় ধরনের R গ্রুপ থাকতে পারে।
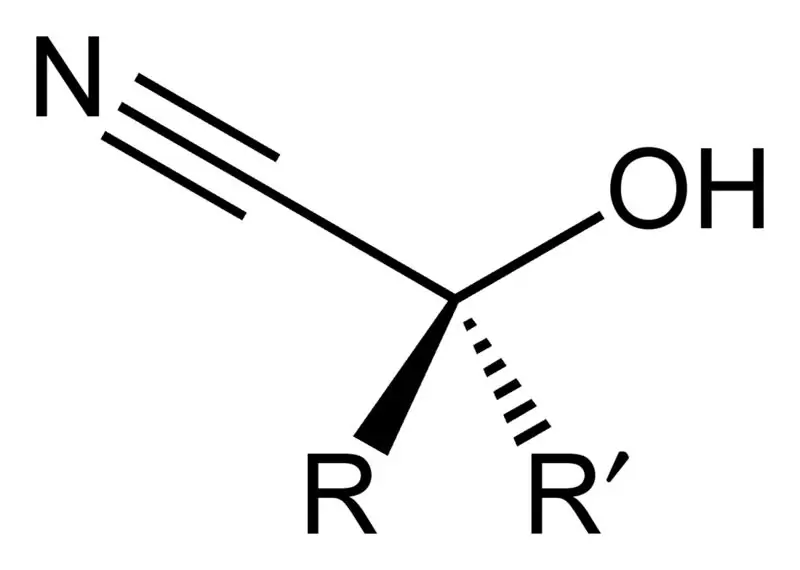
শিল্পগতভাবে, সায়ানোহাইড্রিন যৌগগুলি কার্বক্সিলিক অ্যাসিড উত্পাদন এবং কিছু অ্যামিনো অ্যাসিডের জন্য অগ্রদূত হিসাবে গুরুত্বপূর্ণ। এই সায়ানোহাইড্রিন যৌগগুলি সায়ানোহাইড্রিন বিক্রিয়া থেকে তৈরি হয় যেখানে একটি কেটোন বা অ্যালডিহাইডকে অনুঘটক হিসাবে অতিরিক্ত পরিমাণে সোডিয়াম সায়ানাইডের উপস্থিতিতে হাইড্রোজেন সায়ানাইড (HCN) দিয়ে চিকিত্সা করা হয়। এই উত্পাদন প্রতিক্রিয়ার সময়, হাইড্রোজেন সায়ানাইডের সায়ানো গ্রুপ (CN-) নিউক্লিওফাইল হিসাবে কাজ করে, যা কেটোন বা অ্যালডিহাইডের ইলেক্ট্রোফিলিক কার্বনিল কার্বনকে আক্রমণ করে। এই প্রতিক্রিয়াটি HCN দ্বারা প্রোটোনেশন দ্বারা অনুসরণ করা হয়, যা সায়ানাইড অ্যানিয়নের পুনর্জন্মের দিকে পরিচালিত করে। যাইহোক, আমরা সায়ানাইড লবণ দ্বারা সালফাইটের স্থানচ্যুতি করে সায়ানোহাইড্রিনও প্রস্তুত করতে পারি।
সবচেয়ে সাধারণ এবং গুরুত্বপূর্ণ সায়ানোহাইড্রিন যৌগ হল অ্যাসিটোন সায়ানোহাইড্রিন। এটি অ্যাসিটোনের সায়ানোহাইড্রিন যা মিথাইল মেথাক্রাইলেটের শিল্প উত্পাদনের মধ্যবর্তী হিসাবে গঠিত হয়। এই পদার্থটি তরল হিসেবে বিদ্যমান এবং HCN এর উৎস হিসেবে কাজ করতে পারে।
নাইট্রিল কি?
Nitrile যৌগ হল জৈব যৌগ যার সাধারণ রাসায়নিক সূত্র R-CN। তার মানে এই যৌগগুলির একটি সায়ানো গ্রুপ রয়েছে। অতএব, সায়ানো- শব্দটি সাধারণত শিল্প অ্যাপ্লিকেশনগুলিতে নাইট্রিল শব্দটির সাথে বিনিময়যোগ্যভাবে ব্যবহৃত হয়। নাইট্রিল যৌগগুলির অনেকগুলি গুরুত্বপূর্ণ প্রয়োগ রয়েছে, যার মধ্যে মিথাইল সায়ানোক্রাইলেটের গঠন, সুপারগ্লু, নাইট্রিল রাবার, নাইট্রিলযুক্ত পলিমার যা মেডিকেল গ্লাভস তৈরিতে কার্যকর, ইত্যাদি উৎপাদনে রয়েছে। নাইট্রিল রাবারেরও অনেক প্রয়োগ রয়েছে।; বিশেষ করে স্বয়ংচালিত এবং অন্যান্য সিল হিসাবে জ্বালানী এবং তেলের প্রতি প্রতিরোধের কারণে। আরও গুরুত্বপূর্ণ, সায়ানো গ্রুপ ধারণকারী অজৈব যৌগগুলিকে নাইট্রিল যৌগ বলা হয় না; তাদের পরিবর্তে সায়ানাইড বলা হয়।

গঠন বিবেচনা করলে নাইট্রিল হল রৈখিক অণু। এই অণুগুলি নাইট্রোজেন পরমাণুর সাথে ট্রিপল বন্ড সহ কার্বন পরমাণুর এসপি সংকরায়নকে প্রতিফলিত করে। নাইট্রিল যৌগগুলি মেরু এবং একটি ডাইপোল মুহূর্ত রয়েছে। নাইট্রিল যৌগগুলি তরল হিসাবে ঘটে যার উচ্চ আপেক্ষিক অনুমতি রয়েছে৷
আমরা অ্যামোক্সিডেশন এবং হাইড্রোসায়ানেশনের মাধ্যমে শিল্পগতভাবে নাইট্রিল যৌগ তৈরি করতে পারি। এই উভয় রুটই টেকসই (সবুজ) এবং বিপজ্জনক পদার্থের ন্যূনতম মুক্তি রয়েছে৷
সায়ানোহাইড্রিন এবং নাইট্রিলের মধ্যে পার্থক্য কী?
সায়ানোহাইড্রিন এবং নাইট্রিল যৌগ হল সায়ানো ফাংশনাল গ্রুপ ধারণকারী জৈব যৌগ। সায়ানোহাইড্রিন এবং নাইট্রিলের মধ্যে মূল পার্থক্য হল সায়ানোহাইড্রিন যৌগগুলিতে একটি সায়ানো গ্রুপ এবং একটি হাইড্রক্সি গ্রুপ থাকে যেখানে নাইট্রিল যৌগগুলিতে শুধুমাত্র সায়ানো গ্রুপ থাকে।তদ্ব্যতীত, সায়ানোহাইড্রিন সায়ানোহাইড্রিন বিক্রিয়ার মাধ্যমে উত্পাদিত হয় যখন নাইট্রিল অ্যামোক্সিডেশন এবং হাইড্রোসায়ানেশনের মাধ্যমে উত্পাদিত হতে পারে৷
নীচের ইনফোগ্রাফিক্স সায়ানোহাইড্রিন এবং নাইট্রিলের মধ্যে আরও পার্থক্য সারণী করে।
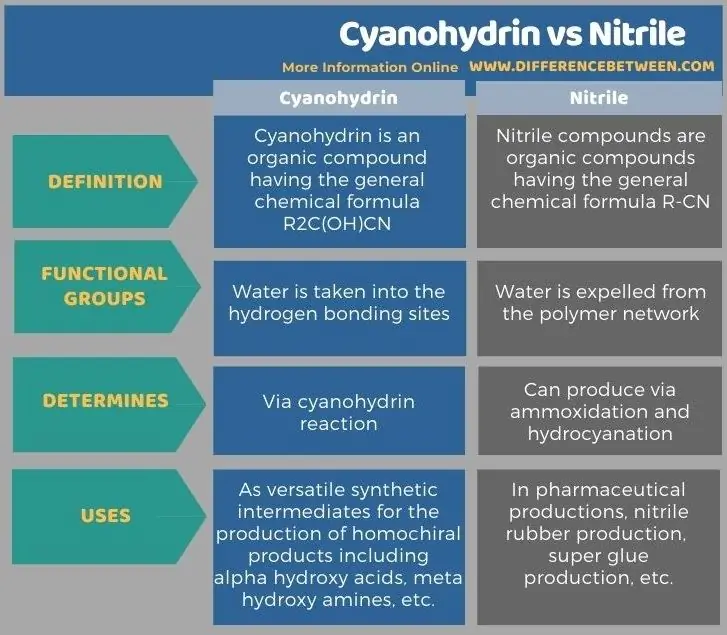
সারাংশ - সায়ানোহাইড্রিন বনাম নাইট্রিল
সায়ানোহাইড্রিন এবং নাইট্রিল যৌগ হল সায়ানো ফাংশনাল গ্রুপ ধারণকারী জৈব যৌগ। সায়ানোহাইড্রিন এবং নাইট্রিলের মধ্যে মূল পার্থক্য হল যে সায়ানোহাইড্রিন যৌগগুলিতে একটি সায়ানো গ্রুপ এবং একটি হাইড্রক্সি গ্রুপ থাকে যেখানে নাইট্রিল যৌগগুলিতে শুধুমাত্র সায়ানো গ্রুপ থাকে৷






