- লেখক Alex Aldridge [email protected].
- Public 2023-12-17 13:33.
- সর্বশেষ পরিবর্তিত 2025-06-01 07:36.
কার্বনিক অ্যাসিড এবং বাইকার্বোনেটের মধ্যে মূল পার্থক্য হল কার্বনিক অ্যাসিড হল একটি নিরপেক্ষ রাসায়নিক যৌগ, যেখানে বাইকার্বনেট হল নেতিবাচক চার্জযুক্ত রাসায়নিক যৌগ৷
কার্বনিক অ্যাসিড হল একটি দুর্বল অ্যাসিড যা দ্রবণে তৈরি হয় যখন কার্বন ডাই অক্সাইড জলে দ্রবীভূত হয়, রাসায়নিক সূত্র H2CO3 সহ। তিনটি অক্সিজেন পরমাণু, একটি হাইড্রোজেন পরমাণু এবং একটি কার্বন পরমাণুর রাসায়নিক সূত্র HCO3-এর সংমিশ্রণে বাইকার্বনেট তৈরি হয়-।
কার্বনিক এসিড কি?
কার্বনিক অ্যাসিড হল H2CO3। কখনও কখনও, আমরা এই নামটি জলে বা কার্বনেটেড জলে কার্বন ডাই অক্সাইড দ্রবীভূত সমাধানকে দিয়ে থাকি।কারণ কার্বনেটেড পানিতে অল্প পরিমাণে H2CO3 থাকে। তদ্ব্যতীত, কার্বনিক অ্যাসিড একটি দুর্বল অ্যাসিড, এবং এটি কার্বনেট এবং বাইকার্বনেট হিসাবে দুটি ধরণের লবণ গঠন করতে পারে। এই যৌগের মোলার ভর হল 62.024 গ্রাম/মোল।
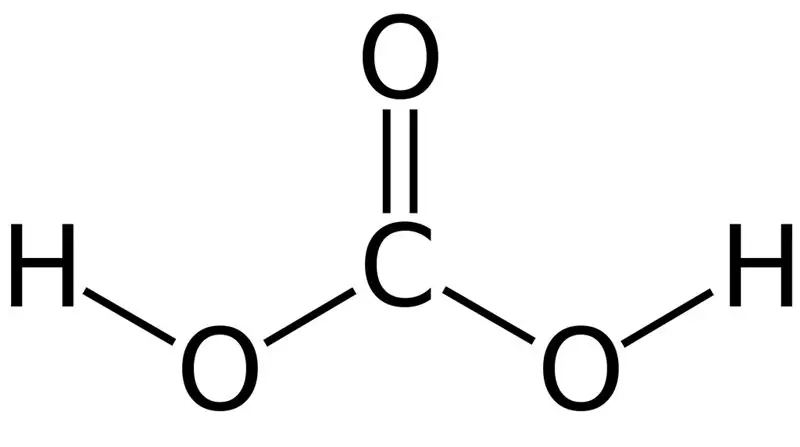
চিত্র 01: কার্বনিক অ্যাসিডের রাসায়নিক গঠন
যখন কার্বন ডাই অক্সাইড পানিতে দ্রবীভূত হয়, তখন এটি কার্বন ডাই অক্সাইড এবং কার্বনিক এসিডের মধ্যে একটি ভারসাম্য প্রবেশ করে। ভারসাম্য নিম্নরূপ:
CO2 + H2O ⟷ H2CO3
যদি আমরা একটি বেসে অতিরিক্ত কার্বনিক অ্যাসিড যোগ করি, এটি বাইকার্বোনেট দেয়। কিন্তু, যদি বেসের আধিক্য থাকে, তাহলে কার্বনিক অ্যাসিড কার্বনেটেড লবণ দিতে থাকে। আরও স্পষ্টভাবে, কার্বনিক অ্যাসিড হল একটি কার্বক্সিলিক অ্যাসিড যৌগ যা কার্বনাইল কার্বনের সাথে দুটি হাইড্রক্সিল গ্রুপের বিকল্প রয়েছে।অধিকন্তু, এটি একটি পলিপ্রোটিক অ্যাসিড, যা প্রোটন দান করতে সক্ষম। এটিতে দুটি অপসারণযোগ্য প্রোটন রয়েছে, তাই এটি বিশেষভাবে ডিপ্রোটিক৷
বাইকার্বনেট কি?
তিনটি অক্সিজেন পরমাণু, একটি হাইড্রোজেন পরমাণু এবং একটি কার্বন পরমাণুর সমন্বয়ে বাইকার্বোনেট তৈরি হয়। এই সংমিশ্রণের পণ্যটি একটি আয়ন বা প্রোটনের চেয়ে বেশি ইলেকট্রন সহ একটি যৌগ হতে পারে। আমরা এটিকে রাসায়নিক প্রজাতি হিসাবে বর্ণনা করতে পারি যার রাসায়নিক সূত্র HCO3-.
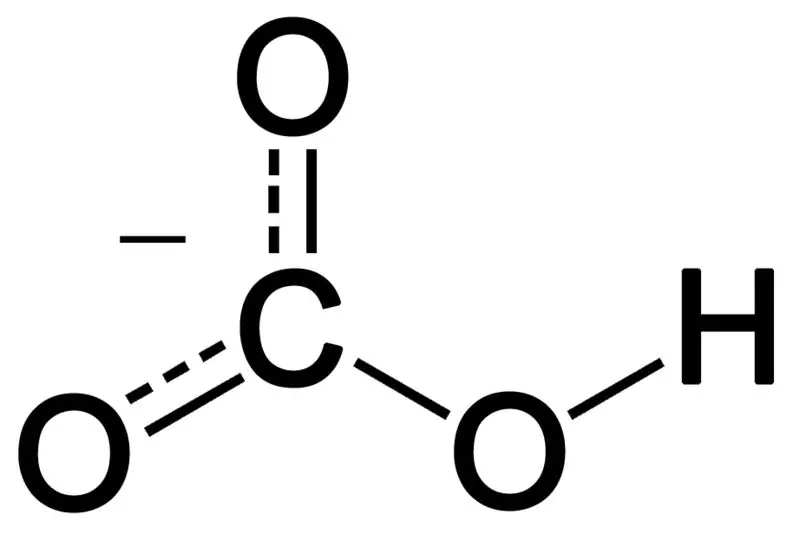
চিত্র 02: বাইকার্বনেট অ্যানিয়নের রাসায়নিক গঠন
এই যৌগটি শরীরের pH বাফারিং সিস্টেমের একটি গুরুত্বপূর্ণ অংশ, সাধারণ মানুষের ভাষায়: এটি একজনের রক্তকে এমন অবস্থায় রাখার জন্য দায়ী যা খুব বেশি অম্লীয় বা খুব মৌলিক নয়। উপরন্তু, এটি পাকস্থলীর খাবার হজম হয়ে গেলে পাচক রস নিয়ন্ত্রণে রাখার একটি উপায় হিসেবে কাজ করে।তদুপরি, বৃষ্টির জলে কার্বনিক অ্যাসিড বাইকার্বনেট আয়ন গঠন করে যখন এটি পাথরে আঘাত করে। বাইকার্বোনেট আয়নের এই প্রবাহ কার্বন চক্রকে সচল রাখার জন্য গুরুত্বপূর্ণ৷
কার্বনিক অ্যাসিড এবং বাইকার্বনেটের মধ্যে পার্থক্য কী?
কার্বনিক অ্যাসিড হল একটি দুর্বল অ্যাসিড যা জলে কার্বন ডাই অক্সাইড দ্রবীভূত হলে দ্রবণে তৈরি হয় এবং এর রাসায়নিক সূত্র হল H2CO3। রাসায়নিক সূত্র HCO3- সহ তিনটি অক্সিজেন পরমাণু, একটি হাইড্রোজেন পরমাণু এবং একটি কার্বন পরমাণুর সংমিশ্রণে বাইকার্বনেট তৈরি হয়। কার্বনিক অ্যাসিড এবং বাইকার্বোনেটের মধ্যে মূল পার্থক্য হল কার্বনিক অ্যাসিড একটি নিরপেক্ষ রাসায়নিক যৌগ, যেখানে বাইকার্বোনেট একটি নেতিবাচক চার্জযুক্ত রাসায়নিক যৌগ। তদুপরি, কার্বনিক অ্যাসিড বুদবুদ, ফিজি পানীয় তৈরিতে, ডার্মাটাইটাইডের চিকিৎসায়, মাউথওয়াশ ইত্যাদিতে ব্যবহৃত হয়, যখন বাইকার্বনেট ব্যবহার করা হয় খাবারের প্রস্তুতিতে যেমন বেকিং (একটি খামির এজেন্ট হিসাবে), এবং এটি পিএইচ-এর পরিবর্তনকে প্রতিরোধ করার ক্ষমতা দেয়।
নিম্নলিখিত ইনফোগ্রাফিক কার্বনিক অ্যাসিড এবং বাইকার্বোনেটের মধ্যে পার্থক্যকে সারণী আকারে পাশাপাশি তুলনা করে।
সারাংশ - কার্বনিক অ্যাসিড বনাম বাইকার্বনেট
কার্বনিক অ্যাসিড হল H2CO3। রাসায়নিক সূত্র HCO3- সহ তিনটি অক্সিজেন পরমাণু, একটি হাইড্রোজেন পরমাণু এবং একটি কার্বন পরমাণুর সংমিশ্রণে বাইকার্বনেট তৈরি হয়। কার্বনিক অ্যাসিড এবং বাইকার্বোনেটের মধ্যে মূল পার্থক্য হল কার্বনিক অ্যাসিড একটি নিরপেক্ষ রাসায়নিক যৌগ, যেখানে বাইকার্বোনেট একটি নেতিবাচক চার্জযুক্ত রাসায়নিক যৌগ৷






